Производство медицинских изделий (МИ) является важнейшим и быстро растущим сегментом индустрии здравоохранения. Производителями медицинских изделий выпускается широчайший спектр продуктов – от сложного диагностического и терапевтического оборудования, до простых медицинских инструментов и расходных материалов, которые используются в медицинских учреждениях, службах экстренной помощи, реабилитации инвалидов и домашних условиях. В последнее время многие производственные компании отрасли добились серьёзных технологических достижений и выросли по экспоненте. Несмотря на жесткое регулирование и финансовое давление на отрасль, рынок продолжает расти во всем мире.
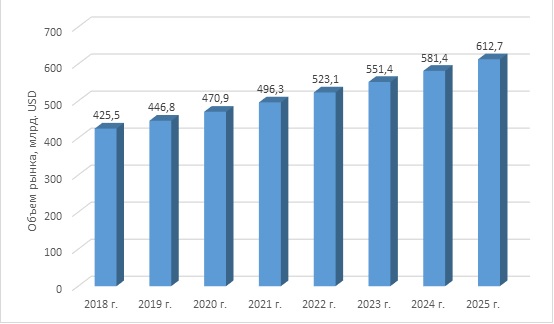
В настоящее время мировой рынок медицинских изделий оценивается в более чем 425 млрд. USD и, согласно оценкам отраслевых экспертов, к 2025 году достигнет показателя 612,7 млрд. USD. (https://www.fortunebusinessinsights.com/industry-reports/medical-devices-market-100085)
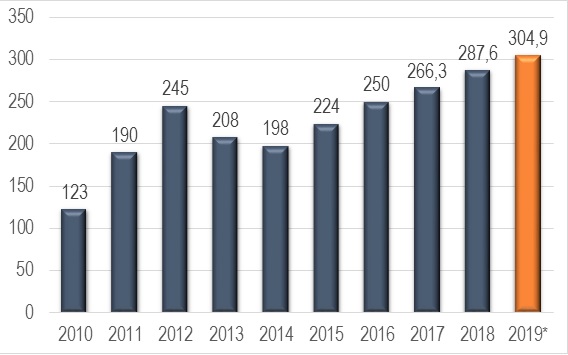
Российский рынок медицинских изделий занимает около 1,5% Мирового рынка. Объем рынка МИ 2019 г. в РФ может составить более 304,9 млрд. рублей, что на 6% больше предыдущего года.
Согласно прогнозам экспертов, к концу 2024 года объем рынка МИ может достигнуть 450 млрд. руб. Как ожидается, доля российских производителей возрастет до 32%. С учетом мер поддержки, доля российских производителей за период до 2024 года увеличится с 23 до 32%. Такому росту рынка будут способствовать нормативные изменения, принятые в 2019 году.
1. В июне 2019 года Премьер-министр РФ Дмитрий Медведев подписал расширенный на 14 позиций перечень медицинских изделий, подпадающих под действие Постановления Правительства Российской Федерации №102 от 5 февраля 2015 года. Предложения по расширению перечня подготовил Минпромторг РФ. Действие постановления распространяется на аппараты ИВЛ, гамма-терапевтические комплексы контактной лучевой терапии средней и высокой мощности, аппараты УЗИ, эндопротезы суставов конечностей, интраокулярные линзы, микроисточники с йодом-125, клейкие перевязочные материалы, в том числе пропитанные или покрытые лекарственными средствами, емкости для взятия, хранения и транспортировки биологических проб, в том числе вакуумные пробирки для взятия венозной крови и пробирки для капиллярной крови, емкости для мочи, кала и мокроты, аппараты наружной фиксации, медицинские функциональные кровати, тонометры внутриглазного давления, воздушные стерилизаторы, суховоздушные термостаты и оториноскопы.
2. В текущем году Минпромторгом РФ были выработаны новые механизмы государственной поддержки медицинской и фармацевтической промышленности, предусматривающие:
В перечень стратегических направлений развития медицинской отрасли вошли разработка и организация производства медицинских изделий в области ортопедии, травматологии и протезирования, тест-систем для in vitro диагностики, выявления онкологических заболеваний и патологий сердечно-сосудистой системы.
3. В начале августа был Президентом РФ был подписан закон о внесении изменений в ФЗ от 31 декабря 2014 года №488 «О промышленной политике в РФ» в части регулирования специальных инвестиционных контрактов. А также в Бюджетный и Налоговый кодексы.
Теперь специальные инвестиционные контракты (СПИК) можно заключать под разработку и организацию производства «современных технологий». При этом СПИК будет заключаться не более чем на 15 лет для проектов, объем инвестиций, по которым не превышает 50 млрд рублей без учета НДС, и не более чем на 20 лет при инвестициях свыше 50 млрд рублей. В предыдущей версии максимальный срок контрактов ограничивался десятью годами.
Кроме того, существовал минимальный объем инвестиций в 750 млн рублей.
Появилась оговорка о стабильности условий для инвестора: на него не действуют утвержденные после даты заключения контракта законодательные изменения, которые могут повлиять на реализацию проекта. Но только в том случае, если для участников СПИК на дату принятия изменений прописан особый порядок.
Инвестор будет определяться через конкурс. Он может быть закрытым, если речь идет о технологиях, связанных с обороной безопасностью государства. Инициатором конкурса вправе выступить как федеральные власти, так и инвестор.
Контракт может быть заключен и без конкурса – по решению президента, если проект имеет стратегическое для экономики или для национальной безопасности значение или если подана единственная заявка.
В СПИК будут прописаны показатели, которых инвестор обязуется достичь: по объему произведенной и реализованной продукции, минимальному набору налогов, сборов и страховых взносов, числу рабочих мест. Устанавливается законом и ответственность за невыполнение или ненадлежащее выполнение условий контракта.
Инвестор должен отдельно учитывать доходы и расходы по проекту, составляющему предмет СПИКа, если ведет еще какую-то деятельность. При этом льготы прекращают действие, если государство потеряло или недополучило от контракта более чем 50% общего объема планируемых инвестиций.
Поправки в Налоговый кодекс предусматривают льготы для заключивших СПИК: нулевая ставка налога на прибыль, зачисляемого в федеральный бюджет, пониженная – в бюджеты субъектов. Изменения в Бюджетный кодекс позволяют предоставлять участникам СПИК субсидии из бюджетов разных уровней более чем на один бюджетный период.
СПИК по обновленному закону можно подписать до конца 2030 года.
Первый СПИК в медтехиндустрии на 3 млрд рублей в начале 2019 года подписали Минпромторг, правительство Нижегородской области и российско-китайская компания «Снабполимер Медицина».
4. В конце января 2019 года Минздрав подготовил поправки в постановление Правительства РФ от 30.09.2015 №1042, определяющее правила ввоза на территорию страны медицинских товаров, которые освобождаются от налога на добавленную стоимость.
Напомним, что сложности возникли в конце 2016 г., в связи с отменой ранее действовавшего общероссийского классификатора продукции (ОКП) и переходом на новый классификатор (ОКПД2), в котором отсутствовала часть кодов. В результате многие медицинские изделия были лишены льготы по НДС.
Поправки в Постановление, подготовленные Минздравом, дополнили перечень кодов общероссийского классификатора продукции по видам экономической деятельности (ОКПД2) по большинству позиций.
В августе Минфином был подготовлен проект, вносящий поправки в Постановление Правительства РФ от 15.09.2008 г. № 688 «Об утверждении перечней кодов медицинских товаров, облагаемых налогом на добавленную стоимость по налоговой ставке 10 процентов».
5. Одним из ключевых событий 2019 года стала разработка перечня медоборудования, для переоснащения клиник по нацпроекту “Здравоохранение”.
В перечень для переоснащения клиник по онкологической программе нацпроекта вошли 147 единиц медизделий, в том числе КТ, МРТ, ПЭТ, ангиографы, аппараты для брахитерапии, различное рентгеновское оборудование и несколько разновидностей ультразвуковых сканеров. А также бронхоскопы, гастроскопы, микроскопы, в том числе цифровые, эндоскопические комплексы, операционное оборудование – наркозные аппараты, мониторы контроля за состоянием пациентов, управляющие системы. В перечень включена и линейка для клинико-лабораторной диагностики, включающая несколько типов анализаторов.
Для оснащения региональных сосудистых центров и первичных сосудистых отделений, расположенных в медорганизациях регионального подчинения в рамках федерального проекта «Борьба с сердечно-сосудистыми заболеваниями» должны быть закуплены 29 видов оборудования и медизделий, включая ангиографические комплексы, МРТ, КТ для исследований сердца и головного мозга, передвижные аппараты УЗИ экспертного класса для исследования сердца и сосудов, аппараты для искусственной вентиляции легких, оборудование для проведения нейрохирургических операций и медицинской реабилитации.
Напомним, что учреждениям Здравоохранения рекомендовано закупать медицинские изделия и оборудование отечественных производителей при «эквивалентных технологических характеристиках».
Для этого Минпромторгом России совместно с Госкорпорациями «Росатом», «Ростех» и другими российскими производителями был составлен сводный перечень продукции.
Минпромторг РФ ожидает, что реализация нацпроекта позволит увеличить долю российских производителей до 40%.
6. В течение всего года велось активное обсуждение возможности продления переходного периода для перерегистрации медицинских изделий, имеющих регистрационное удостоверение в своей стране, по правилам ЕАЭС.
И наконец 9 сентября было опубликовано Распоряжение Коллегии ЕЭК № 142 «О проекте Протокола о внесении изменения в Соглашение о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники) в рамках Евразийского экономического союза от 23 декабря 2014 года».
Согласно представленной информации, Статья 11 «Переходный период» изложена в следующей редакции:
До 31 декабря 2021 г. по выбору производителя медицинского изделия или его уполномоченного представителя регистрация медицинского изделия может осуществляться в порядке, установленном Комиссией, либо в порядке, предусмотренном законодательством государства-члена.
Медицинское изделие, зарегистрированное до 31 декабря 2021 г. в порядке, предусмотренном законодательством государства-члена, может быть перерегистрировано до 31 декабря 2026 г. в порядке, предусмотренном законодательством этого государства-члена, и может обращаться на территории этого государства-члена до окончания срока действия документов, подтверждающих факт государственной регистрации такого медицинского изделия, с правом внесения изменений в регистрационные документы.
7. В ноябре 2017 года Совет ЕЭК утвердил Требования к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения. Документ предусматривает проведение обязательного инспектирования производств медизделий, применение которых сопряжено с высоким риском для благополучия пациента.
16 марта 2019 года окончился переходный период, который предоставлял производителям отсрочку от проведения инспектирования.
Инспектирование предусматривается в рамках регистрации МИ, а также плановое и внеплановое. Внеплановое инспектирование возможно в случае нежелательных событий, связанных с угрозой причинения вреда здоровью и жизни граждан. Плановое инспектирование будет производиться с определенной периодичностью. Нужно понимать, что в случае отрицательного решения по итогам внепланового и периодического инспектирования может стоять вопрос о приостановке, или прекращении производства и обращения медизделия. В зависимости от выявляемых проблем, можно будет устранить несоответствия и провести дополнительное инспектирование, уже в меньшем объеме.
10 июня в штаб-квартире ЕЭК состоялось заседание рабочей группы по оценке регулирующего воздействия проектов решений ЕЭК, подразумевающее оценку их влияния на условия ведения предпринимательской деятельности в Союзе.
На заседании было предложено обеспечить комплексный подход к регулированию деятельности организаций, имеющих право проводить инспектирование производства медицинских изделий.
Также, по мнению членов рабочей группы, необходимо предусмотреть единые требования к таким организациям и унифицированные процедуры наделения их полномочиями по инспектированию в одном документе.
В России проведение инспектирования производств возложено на Росздравнадзор.
В сентябре Минздрав РФ представил проект правил расчета стоимости инспектирования производства медизделий Росздравнадзором РФ.
Стоимость зависит от количества сотрудников предприятия, его географического положения (если производственные площадки находятся в нескольких городах), а также вида инспекции – первичной или периодической.
Максимальный размер платы для производителя медизделий на территории России составит 1,9 млн рублей, из которых 1,27 млн рублей составляют командировочные расходы и 673 тысячи – сама работа инспектора. За пределами РФ – 2,6 млн рублей (1,9 млн рублей командировочных расходов и 673 тысячи – инспектирование).
Росздравнадзор будет оценивать проектирование и разработку медицинского изделия, управление документацией и записями, производство и выходной контроль, процессы корректирующих и предупреждающих действий, связанные с потребителем. Отдельно придется оплатить отбор и испытание образцов имплантируемых, инвазивных медизделий, а также изделий для диагностики in vitro третьего класса риска.
8. Сейчас ведется активная работа в направлении совершенствования процедуры регистрации медицинского программного обеспечения (ПО).
Ассоциация разработчиков и пользователей систем искусственного интеллекта в медицине «Национальная база медицинских знаний» (НБМЗ) и Фонд «Сколково» предлагают упростить государственную регистрацию медицинского ПО, не регистрируя его как медицинское изделие. Для этого был разработан проект ФЗ о внесении изменений в федеральный закон «Об основах охраны здоровья граждан». Он предлагает введение понятия медицинского программного обеспечения (МПО), особый порядок его государственной регистрации и возможность не подвергать ей некоторое виды входящего в МПО программного обеспечения и то ПО, которое им не является.
Министерство здравоохранения РФ законопроект не поддерживает. Росздравнадзор пока также считает, что проблему регистрации медицинского ПО необходимо решать без изменения закона, согласно которому сейчас данное ПО регистрируется как медицинское изделие — на уровне подзаконных актов.
В октябре на отраслевом рабочем совещании Росздравнадзора было принято решение о создании рабочих групп для решения вопросов, связанных с регистрацией медицинского программного обеспечения.
Важным итогом 2019 года можно считать начало продаж локализованной продукции на нескольких предприятиях. Кроме того, были подписаны новые соглашения о стратегическом партнерстве между российскими и зарубежными компаниями.
Поступили в продажу фетальные мониторы FC 1400, выпускаемые на Уральском оптико-механическом заводе имени Э. С. Яламова (УОМЗ). Выпуск нового оборудования был налажен в кооперации с южнокорейской компанией. УОМЗ входит в холдинг «Швабе» Госкорпорации Ростех.
Осенью 2019 года договор о долгосрочном партнерстве подписало еще одно предприятие холдинга «Швабе». Речь идет о соглашении между Красногорским заводом им. С. А. Зверева и ведущим Европейским производителем эндопротезов «Limaсorporate».
На старте проекта Красногорский завод им. С. А. Зверева выступит как дистрибьютор изделий и начнет поэтапный переход к локализации технологий на своей производственной площадке.
Постепенно уровень локализации будет доведен до 51%, а затем планируется организовать в России производство полного цикла.
Кроме того, завод по производству имплантов для травматологии и ортопедии собирается построить в ТОСЭР «Юрга» компания «Дабл медикал.ру2», по технологии китайской компании Double Medical.
Завод будет выпускать из титана и его сплавов пластины для накостного остеосинтеза, винты, штифты для интрамедуллярного остеосинтеза и системы для транспедикулярной фиксации позвоночника.
Инвестор уже заключил договор с одним из крупнейших российских дистрибьюторов — группой «Здоровье», которая будет реализовывать продукцию не только в Кузбассе, но и в других регионах России.
Авторы проекта прогнозируют рост российского рынка имплантов с нынешних 6 до 9 млрд руб. к 2021 году.
В 2019 году соглашение о сотрудничестве подписали российское предприятие «Курганприбор» и немецкая компания «LRS Инжиниринг». Согласно условиям договора, немецкие партнеры предоставят технологию производства коронарных стентов и помогут с приобретением необходимого оборудования.
Первоначальная запланированная мощность должна составить около 50 тысяч стентов в год.
На мощностях подмосковного завода «Наноптика» будет локализовано производство интраокулярных линз Американского производителя Alcon. Изделия, выпускаемые под брендом AcrySof Single Peace, используются для лечения катаракты.
Общий объем инвестиций в проект оценивается в 250–300 млн рублей, мощность завода на первом этапе составит 140–160 тысяч изделий в год.
Alcon модернизировал производственные линии «Наноптики» в Зеленограде, осуществил трансфер технологий и обучение специалистов. По словам генерального директора Alcon в России Татьяны Гатинской, глубина локализации превышает 50%, при этом конечная стоимость отечественной версии интраокулярных линз будет не выше импортной. Партнеры намерены занять не менее 30% рынка данных изделий в России.
Французско-израильская компания Luneau Technology Operations (LTO) совместно с ООО “ТехноСпарка” ГК «Роснано» уже локализовала производство медицинского офтальмологического оборудования в России.
Решение о запуске в России проекта по локализации оборудования было принято в середине 2017 года. А в сентябре 2019 Российское подразделение Visionix Rus получило долгожданное регистрационное удостоверение на диагностический прибор марки Visionix.
В феврале, на Российском инвестиционном форуме в Сочи, GE Healthcare и медицинское подразделение ГК «Росатом» утвердили «дорожную карту» по локализации медицинского оборудования для диагностики и лечения онкологических заболеваний, в частности, позитронно — эмиссионных томографов (ПЭТ). «Дорожная карта» предполагает создание в течение полутора лет локализованного производства ПЭТ/КТ в России с опционом на расширение продуктовой линейки.
Также о своем намерении локализовать производство компьютерных и позитронно-эмиссионных томографов в кластере «Фарммедполис» в Татарстане, заявила Китайская компания MinFound Меdical System. Общий объем инвестиций в проект оценивается в 1–3 млрд рублей. В настоящее время идет согласование меморандума о локализации.
ООО «Фабрика РТТ» входящее в группу «Р-Фарм» подписало соглашение о стратегическом сотрудничестве с американским производителем медицинской техники Varian Inc. Стороны договорились о локализации новой версии линейных ускорителей Halcyon в дополнение к уже собирающимся в подмосковной Дубне Unique и Clinac. Документ, рассчитанный на 5 лет, предполагает сборку 200 аппаратов.
Кроме того, «Р-Фарм Холдинг» заключила договор о стратегическом партнерстве с Canon Medical Systems Corporation (Япония), лидером японского и одним из ведущих игроков мирового рынков продаж аппаратуры для компьютерной, магнитно-резонансной томографий и ультразвуковых исследований.
Договор о стратегическом партнерстве предполагает трансфер технологий и организацию локального производства медицинского оборудования на территории Российской Федерации.
Летом 2019 года открылось российско-словацкое предприятие по производству медицинского оборудования «Хирана+» на территории особой экономической зоны «Технополис «Москва». Завод будет выпускать наркозные аппараты и аппараты искусственной вентиляции легких.
В локализацию российско-словацкого производства вложено более 174 млн рублей инвестиций. Предприятие позволит создать более 30 новых рабочих мест.
Продолжая тему проектов по локализации, заключенных в предыдущие годы, необходимо отметить проект «Фабрики радиотерапевтической техники», которая в 2019 году приступила к производству аппаратов для лечения онкозаболеваний.
Соглашение о намерениях губернатором Московской области Андреем Воробьевым и исполнительным вице-президентом Varian Medical Systems, Inc. Коллин Кеннеди было подписано в 2016 году. Американская сторона предоставляла технологию на систему лучевой терапии и поддержку в ее освоении.
В декабре 2018 года объект был сдан в эксплуатацию. Общий объем инвестиций составил около 900 миллионов рублей. Планируемая выручка после выхода предприятия на полную мощность – свыше 3 миллиардов рублей в год.
Еще одним событием 2019 года стало начало строительства завода компании «Сарштедт» в индустриальном парке «Марьино». Проект реализуется в рамках меморандума о совместной деятельности, заключенного между Правительством Санкт-Петербурга, банком ВТБ и компанией «Сарштедт» на Петербургском международном экономическом форуме в 2018 году.
Немецкая компания Сарштедт производит закрытые системы взятия крови, изделия для трансфузионной медицины, а также системы автоматизации лабораторий.
Таким образом, в настоящее время Правительство РФ принимает меры и законы, направленные на защиту, поддержку и развитие отечественного производства, которые в тоже время не ограничивают возможности трансфера технологий, стимулируют локализацию иностранного производства и разработку проектов с привлечением иностранных инвестиций. Что в свою очередь дает возможность экспертам прогнозировать увеличение темпов роста рынка медицинских изделий в России.