Согласно поправкам в 323-ФЗ «Об основах охраны здоровья граждан в РФ», принятым в 2021 году, производство медицинских изделий должно соответствовать требованиям к внедрению, поддержанию и оценке системы управления качеством медицинских изделий в зависимости от потенциального риска их применения.
Регистрация медизделий по требованиям ЕАЭС включает обязательное инспектирование производства, на предмет соответствия требованиям системы менеджмента качества (СМК) требованиям Решения Совета ЕЭК от 10.11.2017 года № 106.
Внедрение требований СМК также является обязательным для организаций, оказывающих услуги по техническому обслуживанию медицинской техники, в соответствии с Постановлением Правительства РФ от 30 ноября 2021 г. № 2129.
Для каждого клиента формируется индивидуальная программа внедрения системы менеджмента качества, в соответствии с его запросами и целями, подбираются наиболее подходящие инструменты для обеспечения эффективности работы системы.
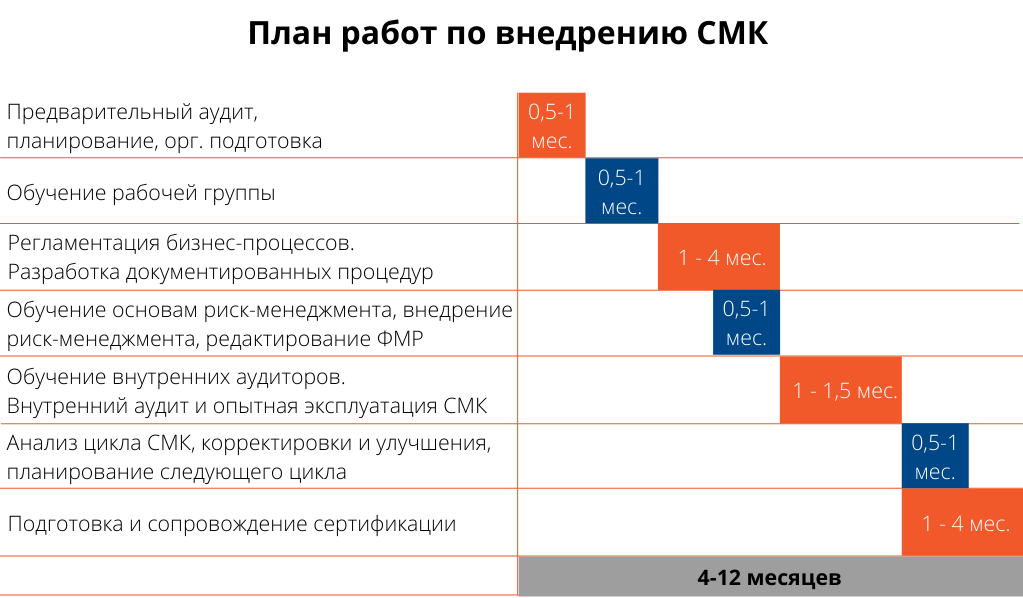
Сроки внедрения зависят от размера организации, особенностей ее функционирования, выбора сертифицирующего органа, а также степени вовлеченности клиента в процесс внедрения системы менеджмента качества. Внедрение СМК вместе с сопровождением сертификации может занимать от 4 до 12 месяцев, рекомендуемая продолжительность – 6 месяцев.
Для организаций, которым срочно требуется зарегистрировать медицинское изделие по правилам ЕАЭС, мы предлагаем программу интенсивного внедрения СМК.
ISO 13485 - это международный отраслевой стандарт, разработанный Международной организацией по стандартизации ISO. Целью стандарта в первую очередь, является повышение качества и безопасности продукции медицинского назначения.
Стандарт ISO 13485 является автономным, он может использоваться отдельно или совместно с другими стандартами систем менеджмента.
Приказом Федерального агентства по техническому регулированию и метрологии от 30 июня 2017 г. №615-ст межгосударственный стандарт ГОСТ ISO 13485 – 2017 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2018 г.
Стандарт ISO 13485-2017 устанавливает требования к системам менеджмента качества для компаний, деятельность которых связана с любым из этапов жизненного цикла медицинского изделия:
Инспектирование производства предусматривается в рамках процедуры государственной регистрации медицинского изделия, а также плановое и внеплановое. Внеплановое инспектирование возможно в случае нежелательных событий, связанных с угрозой причинения вреда здоровью и жизни граждан. Плановое инспектирование производится с определенной периодичностью.
Необходимо понимать, что в случае отрицательного решения по итогам внепланового и периодического инспектирования может стоять вопрос о приостановке, или прекращении производства и обращения медизделия. В зависимости от выявляемых проблем, можно будет устранить несоответствия и провести дополнительное инспектирование, уже в меньшем объеме.
В России проведение инспектирования производств возложено на Росздравнадзор.