Государственная регистрация является обязательной процедурой, необходимой для легального обращения на территории РФ как российских, так и зарубежных медизделий. После успешного прохождения процедуры государственной регистрации, на медицинское изделие выдается регистрационное удостоверение Росздравнадзора.
Стоимость услуг и сроки прохождения процедуры регистрации могут отличаться в зависимости от вида медизделия, класса риска, типа документации, которую необходимо разработать и других факторов.
Государственная регистрация медицинских изделий в РФ осуществляется регистрирующим органом — Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор).
После успешного прохождения процедуры государственной регистрации, сведения о регистрационном удостоверении Росздравнадзора вносятся в Государственный реестр изделий медицинского назначения и медицинской техники. Удостоверение может быть выдано как на отечественную, так и на зарубежную компанию, зарегистрированную, согласно требованиям Российского законодательства.
Получение регистрационного удостоверения Росздравнадзора невозможно без полного пакета технической и эксплуатационной документации, в том числе файла менеджмента риска.
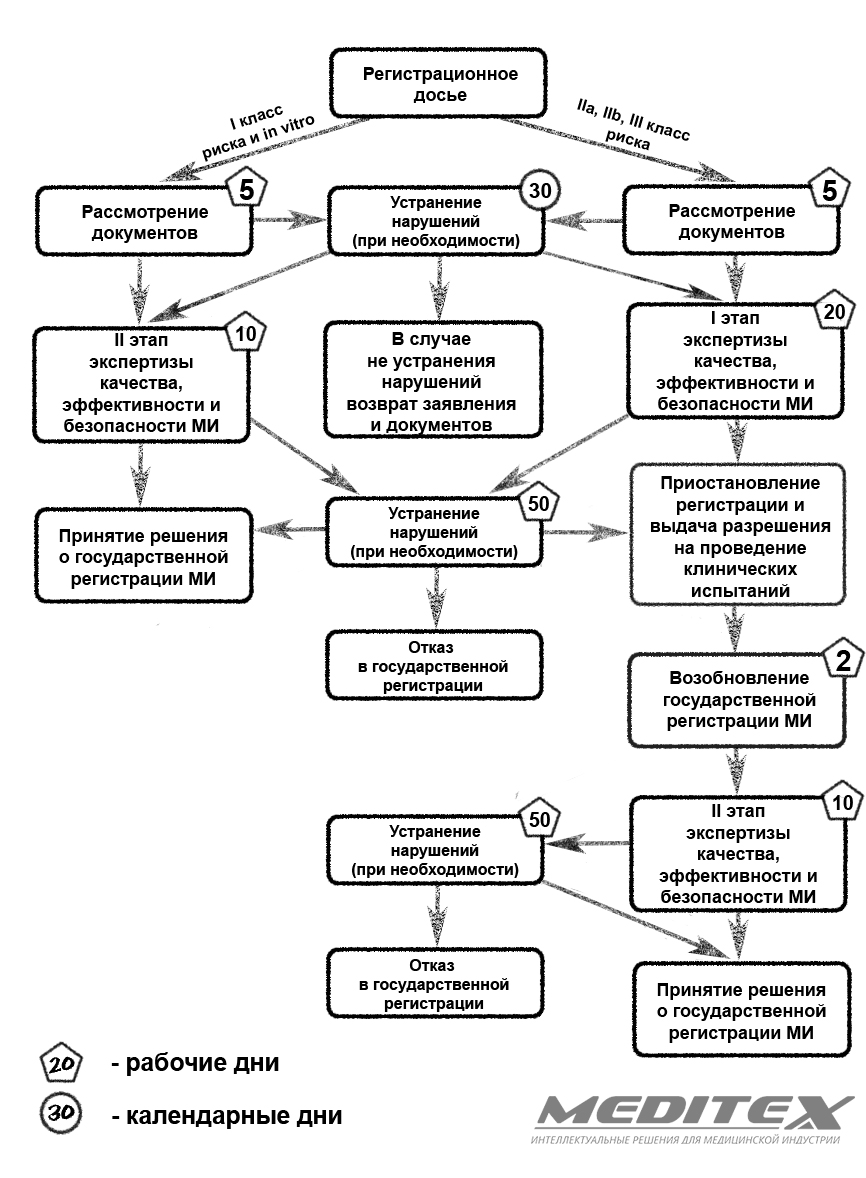
Этапы государственной регистрации медицинских изделий
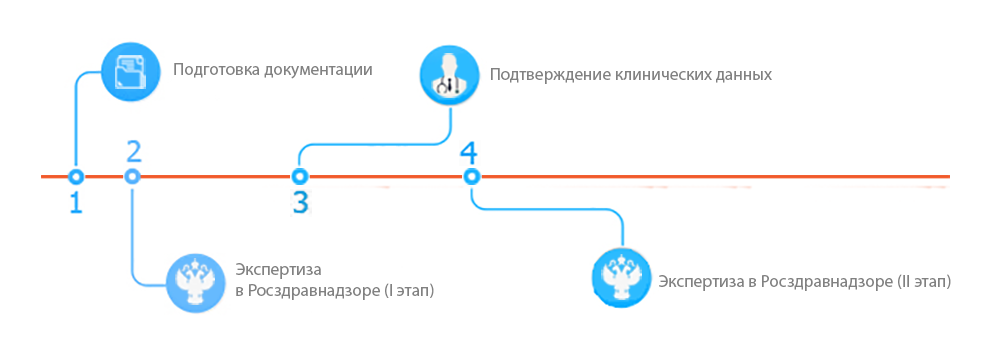
1. Подготовка документации
1.1. Первичная оценка документации на соответствие требованиям Росздравнадзора.
1.2. Корректировка документации в соответствии требованиям Росздравнадзора.
1.3. Получение разрешения на ввоз образцов (только для изделий зарубежного производства)
1.4. Испытания
1.4.1. Проведение токсикологических испытаний
1.4.2. Проведение технических испытаний.
1.5. Формирование и подача досье в Росздравнадзор.
2. Экспертиза в Росздравнадзоре (I этап)
2.1. Комплект регистрационной документации в Росздравнадзоре проходит проверку полноты и достоверности предоставленных сведений.
2.2. Экспертиза качества, эффективности и безопасности проводится экспертной организацией в срок не превышающий 20 рабочих дней.
2.3. По окончании экспертизы составляется заключение о возможности (невозможности) проведения клинических исследований (для медицинских изделий класса риска 2а, 2б и 3).
3. Подтверждение клинических данных
3.1. Проведение клинических испытаний
3.2. Подача клинических данных
4. Экспертиза в Росздравнадзоре (II этап)
4.1. Экспертиза клинических данных в срок не превышающий 10 рабочих дней
4.2. По окончании экспертизы принимается решение о выдачи регистрационного удостоверения