
С 1 января 2022 года медицинские изделия (МИ) будут регистрироваться по правилам Евразийского экономического союза (ЕАЭС). До 31 декабря 2021 года заявление о регистрации медизделия может быть подано в порядке, предусмотренном законодательством государства-члена.
Регистрация медицинского изделия может осуществляться как в одном, так и в нескольких государствах-членах Союза. Документом, подтверждающим факт регистрации медицинского изделия, является бессрочное регистрационное удостоверение. Кроме того, зарегистрированное медицинское изделие маркируется специальным знаком обращения медицинских изделий на рынке Евразийского экономического союза.
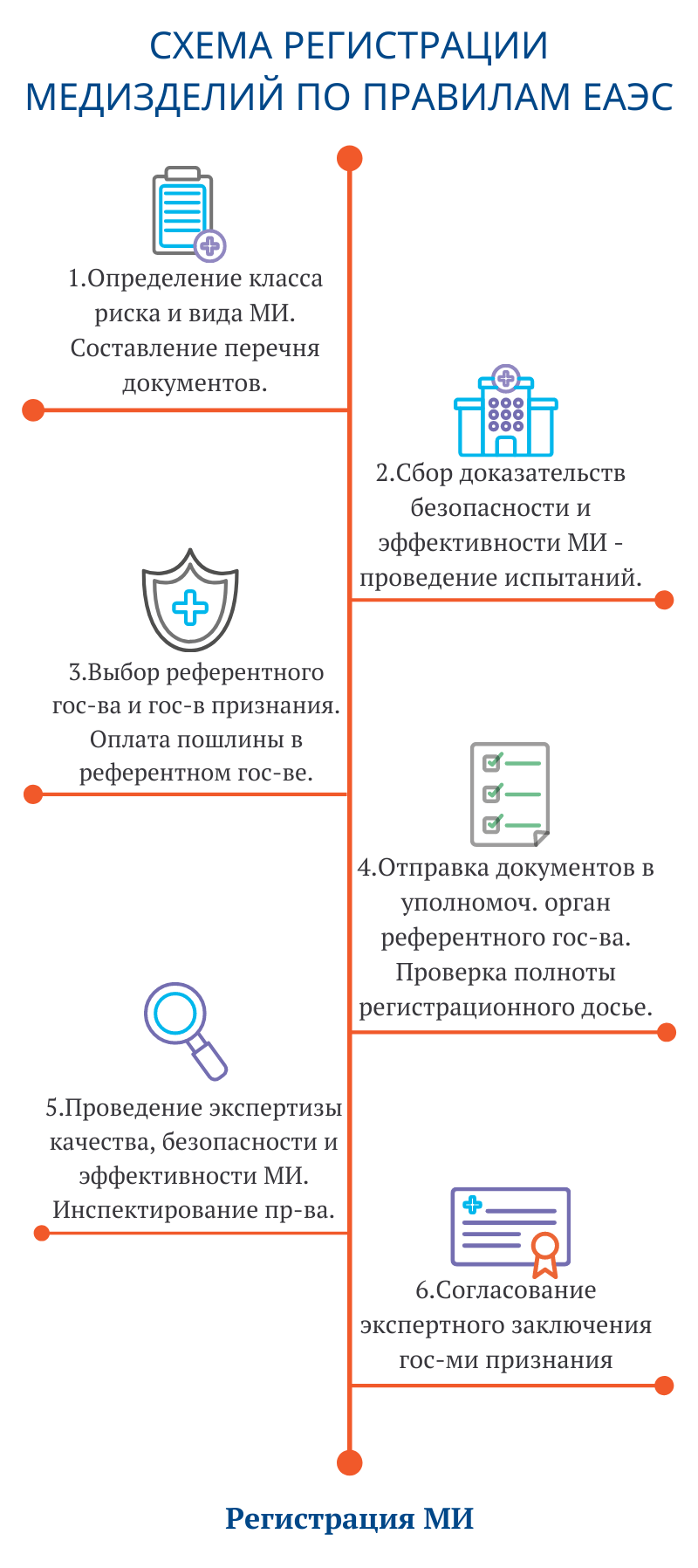
Перечень документов регистрационного досье при регистрации и экспертизе медицинского изделия зависит от номенклатурного вида и класса потенциального риска применения медицинского изделия.
>>Перечень документов для регистрации медицинских изделий по правилам ЕАЭС>>
Для подтверждения соответствия требованиям безопасности и эффективности медицинских изделий, заявитель проводит следующие виды испытаний:
После прохождения вышеуказанных испытаний проводится финализация технической и эксплуатационной документации. Затем заявитель может переходить к клиническим испытаниям.
Проведение клинических испытаний отличается в зависимости от вида медизделий:
Референтное государство – выбранное заявителем государство-член Союза, уполномоченный орган (экспертная организация) которого осуществляет регистрацию медицинского изделия.
В российской Федерации уполномоченным органом, осуществляющим регистрацию медицинских изделий, является Федеральная служба по надзорв в области здравоохранения (Росздравнадзор).
Государства признания – государство-член Союза, уполномоченный орган (экспертная организация) которого осуществляет процедуру согласования экспертного заключения референтного государства.
Максимальный срок проведения проверки полноты и достоверности сведений, содержащихся в заявлении и регистрационном досье – 5 раб. дн.
В случае, выявления уполномоченным органом недостаточности материалов, при проверке полноты и достоверности сведений, содержащихся в заявлении и регистрационном досье, заявителю направляется запрос с указанием характера замечаний и способа их устранения.
Максимальный срок устранения замечаний - 30 раб. дн.
Максимальный срок проведения экспертизы качества, безопасности и эффективности медицинского изделия - 60 раб. дн.
В рамках проведения экспертизы медизделия, для изделий классов риска 2б, 3, а также стерильных изделий класса риска 2а, проводится инспектирование производства.
Инспектирование производства проводится с целью оценки его соответствия требованиям к внедрению, поддержанию и оценке системы менеджмента качества по ГОСТ ISO 13485-2017.
Максимальный срок проведения инспектирования производства – 90 раб. дн. (НЕ входит в общий срок проведения экспертизы качества, безопасности и эффективности МИ).
В случае, выявления уполномоченным органом недостаточности материалов, при проведении экспертизы медицинского изделия, заявителю направляется запрос с указанием характера замечаний и способа их устранения. Максимальный срок устранения замечаний - 60 раб. дн.
В случае, если выводы экспертного заключения относительно возможности регистрации медизделия в референтном государстве являются положительными, уполномоченный орган уведомляет заявителя о необходимости представления копий документов об оплате государственных пошлин в государствах признания.
Уполномоченные органы государств признания должны направить в уполномоченный орган референтного государства подтверждение согласования (несогласования) экспертного заключения в течение 30 календ. дн.
Несогласование экспертного заключения референтного государства в одном из государств признания является основанием для отказа в обращении медизделия на территории этого государства.
Решение о регистрации медицинского изделия принимается уполномоченным органом референтного государства в течение 10 раб. дн. со дня согласования экспертного заключения государствами признания.
+ 10 раб. дн. на оформление регистрационного удостоверения и приложений к нему.